OSTALI SEMINARSKI RADOVI
IZ HEMIJE: |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
ENZIMI
Enzimi ili fermenti su biološki katalizatori (kraće biokatalizatori) koji djelujući u ćelijskoj ili ekstraćelijskoj sredini olakšavaju tok i nastanak veilkog broja biohemijskih reakcija. Praktično, bez prisustva enzima ne bi bilo moguće pretvaranje organskih materija u energiju, niti odvijanje ostalih vidova metaboličke aktivnosti. Iz ovoga proizlazi da bi život kako najprostijih, jednoćelijskih, tako i onih najsavršenijih organizama bio nemoguć.
Već iz ove nepotpune definicije naslućuje se izvjesna sličnost po funkciji enzima i hemijskih katalizatora. Međutim, između katalizatora i enzima postoje, pored očiglednih sličnosti, značajne suštinske razlike.
Iz hemije su dobro poznati značaj i uloga pojedinih katalizatora, bez
čijeg prisustva bi se neke hemijske reakcije odigravale vrlo sporo, dok
se druge uopšte ne bi odigrale. Ulogu katalizatora najbolje ilustruje
klasična hemijska reakcija 2H2 i O2 uz nastanak vode. Na sobnoj temperaturi
molekuili vodonika i kiseonika uopšte ne reaguju i voda ne nastaje:
![]()
2 H2 + O2 nema vode
Međutim, ukoliko se u komori, u kojoj se nalaze molekuli H2 i O2, stvori
električna varnica, hemijska reakcija će se burno odvijati uz oslobađanje
velike količine energije:
![]()
2 H2 + O2 2H2O + energija
Ista reakcija može nastati i na sobnoj temperaturi pod uslovom da se
u komori nalazi sunđerasta platina-katalizator ove reakcije:
![]()
2 H2 + O2 2H2O + energija
Poznato je da tokom hemijske reakcije katalizator podleže izvjesnim fizičkim promjenama, da bi se poslije završene reakcije dobio u prvobitnom obliku i bio u stanju da ponovo uzme učešća u istoj reakciji sa istim molekulima.
Enzimi, bez sumnje, pokazuju neke odlike katalizatora, ali takođe i neke razlike. Prije svega, i enzimi katalizuju pojedine reakcije, ali u biološkoj sredini i biološkim sistemima. Zatim, enzimi su po svojoj prirodi proteini ili složeni proteini. Dalje, nasuprot katalizatorima koji katalizuju više hemijskih reakcija, enzimi uzimaju učešća u malom broju, a najčešće samo u jednoj reakciji (očigledno radi se o većoj specifičnosti enzima prema supstratu). Najzad, dok katalizatori poslije završne hemijske reakcije mogu iznova uzeti učešće u hemijskoj katalizi, enzimi u nekim slučajevima ostaju blokirani, pa je zbog toga potrebno dejstvo drugih enzima, koji djelujući po strogo utvrđenom, kaskadnom, redoslijedu omogućavaju deblokiranje prvih i njihovo ponovno uključivanje u reakciju sa supstratom. Na taj način omogućava se odvijanje nekih biohemijskih reakcija od vitalnog značaja za organizam (npr. respiratorni lanac u mitohondrijama) i višestruko iskorišćavanje enzima u ponovnim reakcijama sa supstratom (pod pojmom supstrata podrazumijeva se supstancija na koju enzim djeluje).
PRIRODA ENZIMA
Po pravilu enzimi su bjelančevine ili proteini. Oni proteini koji ispoljavaju osobine biokatalizatora po svojoj složenosti mogu biti proste belančevine (počev od onih tipa peptida), proteini sa metalnim katjonom odnosno složene bjelančevine ili proteini. U ovom posljednjem slučaju jedan enzim čine dvije komponente — koenzim (ili koferment) i apoenzim (ili apoferment) koji se kombinuju u potpuni enzim holoenzim (ili holuferment):
KOENZIM + APOENZIM = HOLOENZIM ili
KOFERMENT + APOFERMENT = HOLOFERMENT
Apoenzim je prava bjelančevina. Ispoljava sva ona dobro poznata svojstva proteina: termolabilnost, koloidnu prirodu, nemogućnost dijalizovanja, slabu difuziju, zanemarljivo mali osmotski pritisak itd. U sklopu enzima nosilac je specifičnosti prema supstratu. Nasuprot ovome, koenzim je nebjelančevinaste prirode i zbog toga je po pravilu termostabilan, dijalizuje i ovim postupkom se može odvojiti od apoenzima. Ranije se smatralo da od koenzima zavisi tip reakcije koju katalizuje dati enzim (holoenzim). Danas je poznato da jedan isti koenzim (npr, pirodoksalfosfat) može kombinovanjem sa dva različita apoenzima da katalizuje dvije sasvim različite reakcije — dekarboksilaciju i transaminaciju. U prvoj (u dekarboksilaciji) vrši se odvajanje karboksilne grupe (— COOH) od supstrata, dok se u drugoj (u transaminaciji) vrši oduzimanje i prijenos amino grupe (— NH2) sa jednog na drugi supstrat.
Prema tome, specifičnost ne samo prema supstratu već i specifičnost djelovanja (tip reakcije) zavisi od proteinskog dijela (apoenzima), a ne od koenzima. U svijetlu ovih najnovijih saznanja, značaj i uloga koenzima može se poistovjetiti sa nekom vrstom efektorne komponente, koja u holoenzimu omogućava izvođenje date reakcije (dekarboksilaciju ili transaminaciju). Postoji više grupa reakcija za čije odigravanje je neophodno učešće složenih enzima tipa holoenzima. Radi se o reakcijama oksido redukcije, prijenosa pojedinih hemijskih grupa, izomerizacije, uspostavljanju novih veza kovalentnog tipa kao što su C— O, C— S, C— N i C— C. Nasuprot ovim reakcijama, hidrolitičke reakcije, kao što su one koje se odigravaju u digestivnom traktu pod katalitičkim delovanjem hidrolaza ne zahtijevaju učešće složenih holoenzima, već isključivo prostih protein-enzima.
ENZIM |
IZVOR |
FUNKCIJA |
TRIPSIN |
GUŠTERAČA |
RAZGRADNJA PROTEINA |
ELASTAZA |
GUŠTERAČA |
RAZGRADNJA PROTEINA |
TROMBIN |
SERUM |
GRUŠANJE KRVI |
PLAZMIN |
SERUM |
RESORPCIJA UGRUŠAKA |
KALIKREIN |
KRV |
KONTROLA PROTOKA KRVI |
Slika 1. Funkcija nekih enzima
KLASIFIKACIJA I NOMENKLATURA ENZIMA
Na sastanku održanom u Moskvi 1961. godine, Komisija za enzime Međunarodnog društva za biohemiju prijedložila je njihovu klasifikaciju i izvršila njihovu numeraciju. Šifra enzime, to jest broj enzima, sastoji se iz četiri dijela (broja) odvojena tačkama. Brojevi (dijelovi šifre) kombinuju se po specijalnim principima:
Prema prijedlogu ove Komisije, svi enzimi se dijele na šest grupa:
- Oksidoreduktaze – enzimi koji katalizuju reakcije prijenosa elektrona između molekula;
- Transferaze – enzimi koji katalizuju reakcije prijenosa određenih funkcionalnih grupa (amino, sulfatne, metil grupe);
- Hidrolaze – enzimi koji ubrzavaju hidrolitičke reakcije u organizmu;
- Liaze – enzimi koji vrše otcjepljivanje određenih grupa substrata nehidrolitičkim putem; u toku reakcije koju kontrolišu ovi enzimi, dolazi do formiranja dvostrukih veza ili, nasuprot tome, do njihovog zasićivanja;
- Izomeraze – enzimi koji ubrzavaju reakcije izomeracije;
- Ligaze (sintetaze) – enzimi koji katalizuju sjedinjavanje dva molekula, uz korišćenje energije iz ATP-a ili nekog drugog nukleotid – trifosfata.
Prva cifra u šifri enzima kazuje kojoj od pomenutih šest grupa pripada enzima. Druga cifra označava podgrupu enzima. Naime, svaka od šest glavnih grupa podeljenja je na podgrupe, koje su strogo numerisane određenim redom. Tako, na primer, oksido-reduktaze se dijele na podgrupe prema hemijskoj prirodi grupe koja se podvrgava oksidaciji (alkoholna, aldehidna). Grupa transferaza dijeli se na podgrupe prema hemijskoj prirodi grupe koja se prenosi, itd. Treća cifra označava podgrupu podgrupe, što znači da su i podgrupe podeljene na svoje subjedinice. Četvrta cifra u šifri enzima predstavlja redni broj enzima u podgrupi podgrupe.
Šifre nekih enzima:
- Malat – dehidrogenaza (1.1.1.40)
- Fosforilaza (2.4.1.1)
- Alanin – amino – transferaza (2.6.1.1)
- Heksokinaza (2.7.1.1)
- Glukokinaza (2.7.1.2)
- Fosfolipaza (3.1.1.4)
- Alkalna fosfataza (3.1.3.1)
- Kisela fosfataza (3.1.3.2)
MJESTO DEJSTVA ENZIMA
Prema mjestu dejstva enzimi se mogu podijeliti u dvije kategorije - u enzime koji djeluju u ekstraćelijskoj i intraćelijskoj sredini.
Ekstraćelijski enzimi digestivnog trakta (enzimi želudačnog, pankreasnog i crevnog soka), zatim enzimi koji uzimaju učešća u koagulaciji krvi ubrajaju se u kategoriju enzima koji svoje efekte biokatalize ispoljavaju u ekstraćelijskoj sredini. Radi se o velikoj grupi enzima koji katalizuju hidrolitičke reakcije.
Intraćelijski enzimi su vrlo značajni, jer omogućavaju odigravanje onih reakcija koje su od vitalnog značaja za samu ćeliju i organizam u cjelini. Praktičkno, u svakom mikropodručju ćelije i njenim organelama odvija se neka vrsta enzimske aktivnosti. Neke organele se ipak razlikuju od drugih, jer se karakterišu prisustvom raznovrsnih i brojnih enzima. U tom pogledu naročito treba istaći mitohondrije, lizozome, Goldžijev aparat i ribozome endoplazmatskog retikuluma.
MITOHONDRIJE
Ova tjelašca se ubrajaju u najveće ćelijske organele smještene u citoplazmi. U njima se odigravaju procesi od vitalnog značaja: omogućavaju oslobađanje toplotne energije (neophodne za održavanje stalnosti tjelesne temperature homeoterma) i akumulaciju hemijski vezane energije u tzv. fosfatnim jedinjenjima bogatim energijom (ATP i druga jedinjenja). Radi ilustracije značaja navedenih intraćelijskih enzimskih procesa i akumulacije hemijski vezane energije, dovoljno je istaći da se ona koristi: za sintezu novih organskih produkata, za pretvaranje pojedinih sastojaka u druge, za procese razlaganja organskih materija, za niz fizioloških procesa kao što su mišićna kontrakcija, repolarizacija ćelijske membrane, sekreciju žlijezda itd. Prema tome, bez navedene aktivnosti u mitohondrijama život jednog organizma bio bi nezamisliv.
Dužina mitohondrija se procenjuje na 3-4 μm. U strukturi ove organele razlikuje se spoljašnja i unutrašnja membrana, koje su sastavljene iz slojeva proteina i lipidnih molekula. Unutrašnja membrana je naborana sa naglašenim naborima i duplikaturama u kojima je smešten matriks, slika broj 1. Enzimi tipa oksidoreduktaza i komponente tzv. respiratornog lanca nalaze se upravo u sklopu unutrašnje membrane mitohondrija, dok se enzimi ciklusa trikarbonskih kiselina nalaze u samoj tečnosti matriksa.
LIZOZOMI
To su organele po veličini slične mitohondrijama. Značajne su zbog prisustva obilja digestivnih enzima koji omogućavaju intraćelijsko razlaganje proteina, masti, nukleinskih kiselina i drugih makromolekula u manje molekule koji će se potom uključiti u metaboličke procese mitohondrija. Dosada je dokazano više lizozomalnih enzima. Oštećenjem lizozomske membrane dolazi do naglog oslobađanja brojnih hidrolitičkih enzima, koji dovode do digestije (svarivanja) ćelijskih struktura i lize ćelije. Poznato je vise efikasnih činilaca koji mogu da ubrzaju oštećenje lipoproteinske strukture lizozoma i oslobađanje njihovih enzima. To su prije svega osmotski faktori (hipotonična sredina), zatim fizički faktori tipa zvučnih oscilacija, zamrzavanje i otapanje, biohemijski činioci tipa enzima fosfatidaza ili proteinaza, značajni pad pH (izrazito kisela sredina), razni rastvori i deterdženti.
RIBOZOMI
Ova vrsta organela je u neposrednoj vezi sa unutrašnjim membranskim sistemom brojnih kanalića, poznatog pod imenom - endoplazmatski retikulum. Ribozomi su veoma bogati u RNK (ribonukleinske kiseline) i zajedno sa endoplazmatskim retikulumom predstavljaju mjesto gdje se vrši sinteza proteina. Obiluju specifičnim enzimima.
GOLDŽIJEV APARAT
U ovim organelama, smještenim u neposrednoj blizini spoljne membrane, endoplazmatskog retikuluma, vrši se sinteza ugljenohidratnog sadržaja. Veoma su izražene u sekretornim ćelijama i obiluju enzimima tipa transferaza, pomoću kojih se ugljenohidratni sadržaj transportuje i vezuje za peptidne lance (sintetisanih u endoplazmatskom retikulumu) i time doprinose sintezi molekula glikoproteina.
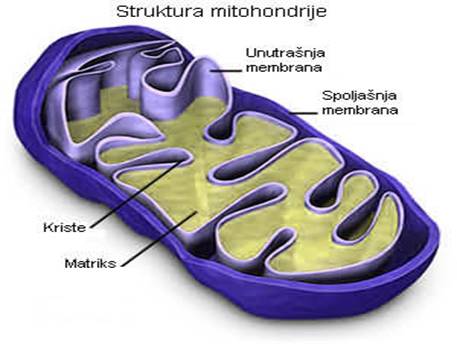
Slika 2. Mitohondrije
MEHANIZAM DEJSTVA ENZIMA
Enzimi kao svojevrsni biokatalizatori ostvaruju svoje dejstvo — biokatalizu,
na taj način što olakšavaju tok odgovarajuće reakcije i ubrzavaju nastanak
ravnotežnog stanja između supstrata, koji ulazi u reakciju, i produkta,
na koji se supstrat razlaže:
![]()
AB A+B
Teorijski posmatrano svaka enzimska reakcija je reverzibilna i pod datim
uslovima može se uspostaviti ravnoteža između AB supstancije i njenih
A + B proizvoda. Na takvu reakciju primenljiv je zakon o dejstvu aktivnih
masa, jer se uspostavlja konstantni ravnotežni odnos između AB supstancije
i nastalih A + B proizvoda. Konstanta ravnoteže u tom slučaju glasi:
K = (CA x CB)/ CAB ili K= ([A] x [B]) / [AB]
gdje je konstanta (K) jednaka količniku između proizvoda koncentracije produkata (CA x CB) i koncentracije supstancije koja se razlaže (CAB). Ukoliko konstanta (K) ima veću brojnu vrijednost, utoliko je veći broj molekula AB razložen na svoje sastojke i obratno.
Jedan od očiglednih primjera enzimskog dejstva i uspostavljanja ravnotežnog stanja između supstancije koja se razlaže i njenih produkata je sinteza odnosno razlaganje ugljene kiseline u eritrocitima pod katalitičkim djelovanjem enzima karboanhidraze. U plućnom krvotoku, gdje postoje uslovi za razlaganje ugljene kiseline, reakcija se odvija na sledeći način:
![]()
H2CO3 H2O + CO2
Svakako, zbog gubitka CO2 plućnom ventilacijom, reakcija će se odvijali u smislu razlaganja ugljene kiseline, kako bi se uspostavila poremećena ravnoteža. U tom slučaju:
K = ([H2O] x [CO2]) / [H2CO3]
Cirkulacijom krvi eritrociti dospijevaju u tkivne kapilare velikog krvotoka,
gdje postoje uslovi za odavanje kiseonika i sintezu ugljene kiseline.
Zbog toga će u eritrocitima enzim karboanhidraza djelovati u smislu uspostavljanja
ravnoteže između nagomilavajućeg CO2 i ugljene kiseline, na taj način
što će se ova intenzivno sintetisati. Reakcija se odvija:
![]()
H2O + CO2 H2CO3
I ovaj ravnotežni odnos može se predstaviti primjenom zakona o dejstvu aktivnih masa:
K = [H2CO3] / ([CO2] x [H2O])
Poređenjem K iz dvije prethodne jednačine lako se uočava da se ravnotežni odnos u prvoj reakciji uspostavlja razlaganjem ugljene kiseline, a u drugoj njenom sintezom. Kako i u jednom i drugom slučaju reakcije katalizuje isti enzim (karboanhidraza), postaje sasvim razumljivo da enzimi u suštini uvek djeluju u smislu uspostavljanja ravnoteže između reagujućih supstancija i njihovih produkata (AB, A i B, odnosno H2CO3, C02 i H2O) . Međutim, na pravac i tok jedne reakcije može se uticati uvođenjem novih kollčina supstancije koja se razlaže (AB ili H2CO3) odnosno uklanjanjem njenih prudukata (A i B odnosno CO2 i H2O). U takvim uslovinia reakcija će se odvijati u pravcu razlaganja ili sinteze, sve dok se pod kataliličkim djelovanjem enzima ne uspostavi narušena ravnoteža.
Slika 3. Mehanizam enzimske reakcije
ENERGETSKI EFEKTI ENZIMSKIH REAKCIJA
Tokom neke hemijske reakcije može se osloboditi izvjesna količina energije, što je, svakako, u direktnoj zavisnosti od energetskog potencijala kojim data supstancija raspolaže:
AB ![]() A + B + ENERGIJ A
A + B + ENERGIJ A
Reakcija je burnija ukoliko se oslobodi veća količina energije i obratno. Reakcije u kojima se oslobađa manja ili veća količina energije nazivaju se egzergonim ili egzoenergetskim, za razliku od onih reakcija za čije odigravanje je potrebno uvođenje i utrošak energije. Ove posljednje se nazivaju endergonim ili endoenergetskim reakcijama.
Pošto se prve, egzoenergetske ili egzergone, odvijaju uz oslobađanje i gubitak odgovarajuće energije, usvojeno je da u tim slučajevima oslobođena energija ima negativan (— ) znak. Praklično, negativan znak za oslobođenu energiju predstavlja i označava njen gubitak tokom reakcije:
![]()
AB A + B — ENERGIJ A
Ukoliko se, pak, tokom razlaganja neke supstancije oslobađa i gubi veća količina energije, utoliko postoje manji uslovi za povratnost (reverzibilnost) te reakcije i odigravanje sinteze iste supstancije. Ipak, do ovoga dolazi u organizmu u tzv. spregnutim reakcijama, gdje odigravanje jedne egzoenergetske reakcije služi kao izvor oslobođene energije neophodne za odigravanje druge endoenergetske reakcije.
Oslobođena ili vezana energija tokom neke reakcije označava se simbolom ΔG° (delta G°), koji se izračunava iz sledećeg obrasca:
ΔG° = — RTInK
gdje R predstavlja gasnu konstantu izraženu u 1,937 cal/mol x stepen, T apsolutnu temperaturu (— 273°C), ln prirodni logaritam i K konstantu ravnoteže pri temperaturi T. Indeks ° u simbolu ΔG° označava određivanje energije u standardnim uslovima, kada su supstancije rastvorene u čistom rastvoru u koncentraciji od 1 mol/litar. U svim drugim uslovima koncentracije, dobija se druga vrednost i izražava samo sa ΔG, a izračunava prema formuli:
ΔG = ΔG° + RTln ([A] x [B] / [AB]
SPECIFIČNOST ENZIMA
Po pravilu enzimi pokazuju veliku specifičnost prema supstratu (supstancija koja se razlaže) i prema vrsti reakcije koju katalizuju. Najčesće enzimi katalizuju samo jednu reakciju ili vrlo mali broj reakcija. Ovo, svakako, nije slučaj i sa neproteinskim katalizatorima, koji imaju široku primjenu u industriji. Već je istaknuto da specifičnost enzima prema supstratu i specifičnost djelovanja (tip reakcije koju enzim katalizuje) zavise od apoenzima, a ne od koenzima (primjer koenzima piridoksal-fosfata koji ulazi u sastav dekarboksilaze i transaminaze).
Specifičnost enzima prema supstratu može se lako objasniti podudarnošću enzima prema supstratu. Ukoliko se neki supstrat predstavi u pojednostavljenom obliku — kao jedan atom ugljenika, za čije su 4 valence vezane 4 grupe od kojih su 2 identične (slika 1), tada postoji samo jedan mogući položaj supstrata koji omogućava njegovo stabilno vezivanje, sa 3 tačke, za aktivno mjesto enzima.
Međutim, pošto je enzim protein, koji se odlikuje ne samo primarnom (peptidinom) strukturom, već takođe sekundarnom, tercijarnom, a u nekim slučajevima i kvaternernom strukturom, bilo bi mnogo ispravnije ukoliko bi enzim bio predstavljen kao dio a-heliksa.
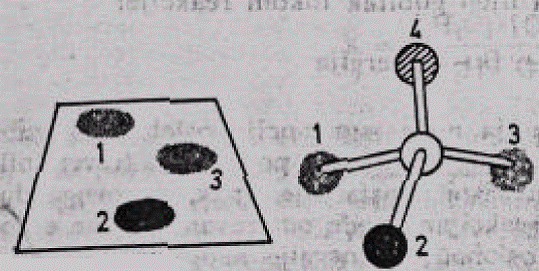
Slika 4. Šematizovani prikaz prostornog odnosa supstrata i aktivnog mjesta enzima

Slika 5. Prikaz vezivanja supstrata u 3 tačke za α -heliks enzima
U svakom slučaju, na osnovu principa podudarnosti enzima prema supstratu sasvim je lako moguće razumjeti zbog čega enzim alfa-glukozidaza (ili maltaza) hidrolizuje alfa, a ne i beta-glukozide, zatim zbog čega enzimi glikolitičkog razlaganja i direktne oksidacije glukoze katalizuju razlaganje tzv. D, a ne d L fosfošećera, odnosno da daleko najveći broj enzima sisara djeluje na L, a ne i na D oblike aminokiselina.
Ukoliko se u ćeliji, u organizmu jednovremeno nađe nekoliko srodnih supstrata, tada će enzimi djelovati sa onim koji pokazuje najveću specifičnost i podudarnost. Međutim, u slučaju da se manje specifičan supstrat nalazi i u znatno većoj koncentraciji od specifičnog, tada se može desiti da drugi manje specifičan supstrat, zbog veće koncentracije ranije dođe u kontakt sa enzimom i tako zauzme mjesto specifičnom supstratu.
POSEBNE SPECIFIČNOSTI ENZIMA
Pojedini enzimi pokazuju specifičnost reagovanja prema odgovarajućoj grupi, dijelu molekula, vrsti veze u složenom molekulu supstrata. Tako himotripsin hidrolizuje peptidnu vezu na onom mjestu peptidnog lanca gdje aromatična aminokiselina (fenil-alanin, tirozin ili triptofan) vezana svojom karborksilnom grupom. Karboksipeptidaze i aminopeptidaze hidrolizuju peptide sa karboksi (— COOH) odnosno amino (— NH2) terminalnog kraja. Zatim, enzimi oksidoreduktaza tipa NAD i NADP, iako su podjednako dobri kao primaoci (akceptori) elektrona i vodonika, pokazuju neka odstupanja kad su u pitanju pojedini biohemijski procesi. U procesima biosinteze (sinteza masnih kiselina) redukovani oblici NADPH se koriste kao redukciona sredstva (kao davaoci vodonika), dok se u procesima razlaganja NAD enzimi koriste kao oksidaciona sredstva.
AKTIVIRAJUĆA ULOGA ENZIMA
Molekuli supstrata u rastvoru ispoljavaju svoju dobro poznatu osobinu kretanja, na čemu se i zasniva njihova sposobnost difuzije. Pošto se sve rastvorene čestice, naročito pravih rastvora, ponašaju kao molekuli gasova, osnovni zakoni koji važe za gasove (Avogadrov, Bojl-Mariotov, Gej-Lisakov i Daltonov zakon) su primjenljivi i na molekule rastvorenih supstancija. Tako će u zavisnosti od temperature brzina kretanja molekula rastvorenih supstancija biti direktno uslovljena.
Na temperaturi apsolutne nule (— 273°C) kretanje rastvorenih čestica prestaje, dok će pri svakom njenom povećanju brzina kretanja posmatranih molekula biti veća. U takvim uslovima, kada se kretanje molekula povećava, povećava se i mogućnost njihovih međusobnih sudara. Ovim se stvaraju mogućnosti da tokom brojnih sudara molekuli dve rastvorene čestice stupe u hemijsku reakciju; jer će u zavisnosti od kinetičke energije molekula postojati mogućnost probijanja tzv. barijerne energije.
Pomenuta barijerna energija onemogućava spontanu reakciju između molekula dve supstancije, pa je zbog toga neminovno potrebna aktivacija molekula u smislu povećanja njihove kinetičke energije i brzine kretanja. Na taj način se povećava broj njihovih sudara i u zavisnosti od prirode reagujućih supstancija, stvaraju se uslovi za probijanje energetske barijere i početak hemijske reakcije. Svi faktori koji povećavaju kinetičku energiju molekula u rastvoru, (povećavajući brzinu njihovog kretanja, povećavaju izglede na njihove međusobne sudare) imaće za posledicu probijanje barijerne energije i započinjanje reakcije. Obrnuto, svi oni faktori koji smanjuju kinetičku energiju, smanjuju brzinu reakcije ili je potpuno onemogućavaju.
Najprostiji primer stvaranja uslova za hemijsku reakciju nekih supstancija je povećavanje temperature rastvora, jer se time ubrzava kretanje njihovih molekula, povećava broj sudara i olakšava probijanje barijere energije. U organizmu čoveka i svih homeoterma (toplokrvnih životinja) su brojne biohemijske reakcije, u sklopu normalne metaboličke aktivnosti, odigravaju se na konstantnoj temperaturi od oko 37°C. Međutim, i na toj tjelesnoj temperaturi mnoge biohemijske reakcije odigravaju se vrlo sporo i dugo, pa bi tako mnogi fiziološki procesi bili dovedeni u pitanje ili sasvim onemogućeni. Enzimi, kao biološki katalizatori, su veoma značajni činioci, jer omogućavaju savlađivanje barijerne energije i odigravanje mnogobrojnih biohemijskih reakcija upravo u uslovima temperature tela.
USLOVI ZA DEJSTVO ENZIMA
Postoji nekoliko uslova koji značajno mogu da utiču na enzimsku reakciju, a to su prije svega: odnos enzim/supstrat, temperalura, pH, aktivatori, inhibitori itd.
KONCENTRACIJA ENZIMA
Određivanje početne brzine razlaganja tokom neke enzimske reakcije pokazalo je da je početna brzina (v) upravo srazmerna koncentraciji enzima, pod uslovom da je koncentracija supstrata (S) nepromjenljiva veličina.
Definicija postaje lako razumljiva ako se ima u vidu da se na samom početku enzimske reakcije vrlo mali broj molekula enzima (Enz) uspkeo da veže i reaguje sa supstratom (S), pa tako svako povećanje broja molekula enzima direktno vodi u srazmjerno povećanje početne brzine (v). Tokom te reakcije nastaje prolazno vezivanje enzima (Enz) i supstrata (S), zbog čega će u narednoj etapi enzimske reakcije nastati produkt (P) uz oslobađanje enzima:
![]()
Enz + S Enz – S
![]()
Enz – S Enz + P
Međutim, pošto su sve enzimske reakcije reverzibilne, treba očekivati uspostavljanje ravnotežnog odnosa između slobodnog enzima i supstrata sa jedne i slobodnog enzima i nastalog produkta sa druge strane:
![]()
Enz + S Enz + P
Ukoliko bismo željeli da izrazimo veličinu razlaganja tokom enzimske reakcije, onda bi ova bila jednaka proizvodu supstrata, enzima i konstante (K1), ili konkretnije:
R1 = K1 •[Enz] •[S]
Kako enzimska reakcija ima i povratan tok, vcličina resinteze date1* enzimske reakcije (R-1) biće:
R-1 = K-1 [Enz] • [P]
Uspostavljanjem ravnoteže tokom enzimske reakcije dobija se nova vrijednost konstanta ravnoteže dvije suprotne reakcije:
K = K1 / K-1 = ([Enz] •[P]) / [Enz] • [S]) = [P] / [S]
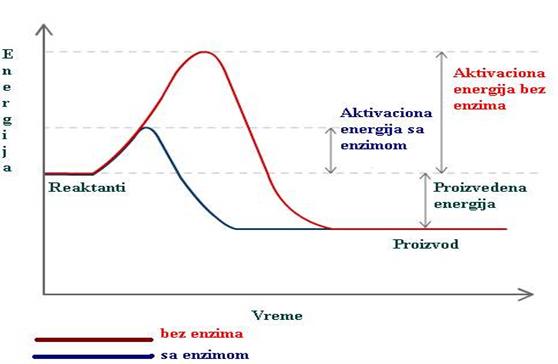
Iz svega navedenog proizilazi, da uprkos činjenici što je u početku enzimske reakcije početna brzina (v) upravo srazmerna koncentraciji enzima, koncentracija enzima u krajnjoj liniji nema nikakav efekat na konstantu ravnoteže. U termodinamskom smislu konstanta ravnoteže enzimske reakcije je u svakom slučaju ista, bez obzira da li je ta ravnoteža postignuta sa ili bez enzima. Znači, enzim jedino postiže brže uspostavljanje ravnoteže, dok je ukupna oslobođena energija (ΔG) ista u brzoj, enzimski katalizovanoj, i vrlo sporoj, spontanoj reakciji.
KONCENTRACIJA SUPSTRATA
U uslovima one enzimske reakcije kada je koncentracija enzima (Enz) nepromjenljiva veličina, svako povećavanje koncentracije supstrata ima za posljedicu povećavanje početne brzine (v) sve do njene maksimalne vrijednosti (V), slika broj 6. Do ovoga dolazi zbog toga što je u samom početku enzimske reakcije (tačka A na slici broj 6.) samo mali broj molekula supstrata vezan za molekule enzima. Svako povećanje koncentracije supstrata (S) ima za direktnu posledicu povećavanje broja kompleksa Enz— S, pa će početna brzina ubrzo dostići svoj maksimum (V). Trenutak kada se u nekoj enzimskoj reakciji dostigne maksimalna brzina, označava maksimalno zasićenje enzima supstratom.

Slika 6. Uticaj koncentracije supstrata
na brzinu enzimske reakcije.
V — maksimalna i v = početna brzina; A = početak reakcije, B = poluzasićenje,
C = zasićenje enzima supstratom
UTICAJ TEMPERATURE
Temperatura sredine u kojoj se odigrava neka enzimska reakcija može u znatnoj mjeri da utiče na brzinu enzimske reakcije. Pokazalo se da svako povećanje temperature za lO°C udvostručava brzinu enzimske reakcije. Ova pojava se objašnjava na taj način što se povećanjem temperature povećava kinetička energija reagujućih molekula (supstrata i enzima), pa će zbog veće brzine kretanja čestica doći do njihovog bržeg sudara i ranijeg kombinovanja. Iz svega navedenog, sasvim je logično očekivati i dobiti brži enzimski efekat.
Ipak, prilikom razmatranja efekta temperature na enzimsku reakciju treba
uvijek imati u vidu činjenicu da su enzimi proteini i da će svako veće
povećanje temperature, naročito iznad 50°C, imati za posljedicu denaturisanje
enzima, a time i njegovu ireverzibilnu (nepovratnu) inaktivaciju.
Obratno, svako smanjenje temperature za nekih 10°C uslovljava dvostruko
smanjenje brzine enzimske reakcije. Praktično, na 0°C aktivnost enzima
prestaje. Vrlo je značajno istaći da enzimi na niskim temperaturama privremeno
gube svoje biokatalitičke sposobnosti. Zbog toga se proteinski materijal
uspješno čuva u zaleđenom stanju na niskim temperaturama (— 20°C), Otapanjem
i povećavanjem temperature do tzv. optimuma dobija se prvobitna enzimska
aktivnost.
UTICAJ pH
Svaki enzim ima svoju optimalnu vrednost pH, pri kojoj se postiže maksimalni enzimski efekat. Veće promene pH mogu značajno da utiču na aktivnost enzima. Enzimi kao proteini su vrlo podložni ulicaju pH, jer se uz pomoć ovog faktora utiče na disocijaciju reaktivnih grupa enzima, ali isto tako i disocijaciju samog supstrata.
Ispitivanjem zavisnosti enzimskih reakcija od različitih vrijednosti pH pokazalo je da daleko najveći broj enzima ispoljava svoju aktivnost uglavnom u rasponu pH od 5,0 do 9,0. Svakako, od ovog pravila postoje izvjesna odstupanja. Tako je za pepsin optimalni pH = 0,5 – 2,5, a za tripsin 7.0 – 10,0.
Postoje uglavnom dva prihvaćena načina na koji pH utiče na enzimsku aktivnost:
- mogućnost denaturisanja enzima kao proteina pri ekstremno niskim ili visokim vrednostima pH, i
- promjene pH mogu uticati na disocijaciju enzima i supstrata i na taj način enzimska reakcija može biti usporena ili ukočena.
Enzimi |
pH optimum |
Lipaze (gušterača) |
8,0 |
Pepsin |
1,5 – 1,6 |
Tripsin |
7,8 – 8,7 |
Ureaze |
7,0 |
Amilaze (gušterača) |
6,7 – 7,0 |
Maltoza |
6,1 – 6,8 |
Kataloza |
7,0 |
Slika 7.Idelalna pH vrijednost za neke enzime
AKTIVATORI ENZIMA
Postoji više poznatih aktivatora enzima. Tako je za aktivnost amilaze potrebno prisustvo Cl– jona, pepsina H+, enzima koji reaguju sa ATP prisustvo Mg2+, dok se brojne peptidaze aktiviraju jonima Mn2+, Zn2+, Co2+.
Vrlo često se ne radi o nekoj većoj specifičnosti aktivatora, jer je dovoljno da se jedan dvovalentni katjon zameni drugim iste valence, a da ne dođe do značajnijih promena aktivnosti.
O mehanizmu dejstva aktivatora jona na enzimsku aktivnost postoji više objašnjenja.
Pored navedene akitvacije pod dejstvom jona, postoje enzimi koji se aktiviraju tek poslije parcijalne hidrolize pod dejstvom nekog drugog enzima.
Kao najbolji i najočigledniji primjer može se uzeti tripsinogen koji
se pod dejstvom enterokinaze, iz crevnog soka, aktivira u tripsin. Tokom
ove aktivacije, enterokinaza odvaja jedan heksapeptid (sastavljen iz valina,
4 asparaginske kiseline i lizina) i omogućava funkciju katalitičkog centra
tripsina:
Enterokinaza
![]()
Tripsinogen Tripsin + heksapeptid (Val-4 Asp-Liz)
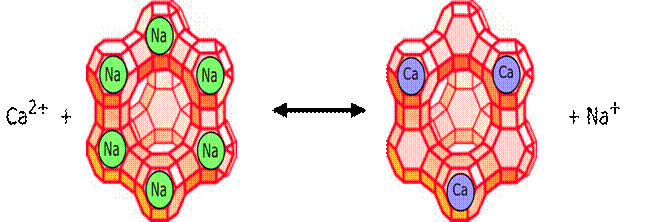
Slika 9.Metalni aktivatori enzima
INHIBITORI ENZIMA
Postoji široka skala enzimskih inhibitora. Generalno uzevši mogu se podijeliti u dvije grupe, u: konkurentsku i nekonkurentsku inhibiciju.
KONKURENTSKA INHIBICIJA
Ova vrsta inhibicija nastaje u slučajevima manje ili veće strukturne sličnosti
supstrata i neke supstancije koja ima ulogu inhibitora. Zove se konkurentskom
zbog toga što između supstrata i inhibitora postoji neka vrsta konkurencije
za aktivno mjesto u enzimu. U takvim slučajevima, pogotovu ako je inhibitor
prisutan u većoj koncentraciji od supstrata, nastaje kompleks enzima i
inhibitora (Enz-I) umjesto sa supstratom (Enz-S). Nastali kompleks može
da disosuje:
![]()
Enz – I Enz + I
naročito u uslovima povišene koncentracije supstrata.
Kao tipičan primjer konkurentske inhibicije uzima se konkurencija između malonske kiseline (ima ulogu inhibitora) i ćilibarne kiseline (supstrat).
NEKONKURENTSKA INHIBICIJA
Ovaj vid inhibicije može biti dvojak, reverzibilan i ireverzibilan (nepovratan).
Reverzibilna nekonkurentska inhibiclja
Iz naziva se vidi da tokom ove inhibicije ne postoji konkurencija između supstrata i inhibitora. Razlog ovome su značajne strukturne razlike. Zbog čega se inhibitor ne vezuje za aktivno mesto, već za bilo koju drugu regiju enzima. Upravo zbog toga i ne postoji konkurencija inhibitora i supstrata za ograničenu regiju — aktivno mjesto enzima. Pošto se supstrat (S) i inhibitor (I) vezuju za različita mjesta nastaće sljedeći kompleksi ,Enz-I, Enz-S i Enz-IS. Kompleks Enz-S omogućava odvijanje biokatalize u normalnom obimu, dok Enz-IS pokazuje donekle smanjenu aktivnost (vezivanje inhibitora izaziva izvjesne promjene u konformaciji enzima, zbog koje je aktivnost neminovno umanjena). Kao rezultat nastalih promjena dobija se sniženje maksimalne brzine enzimske reakcije, dok je Km (Michaels-ova konstanta) nepromjenjena. Ova konstatacija se najbolje shvata iz sljedećeg prikaza:
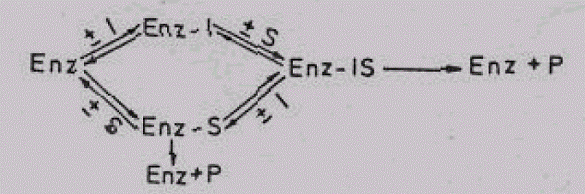
Slika 10. Reverzibilna nekonkurentska inhibiclja
Kompleksi Enz-S daće normalnu količinu proizvoda (P), dok će P iz Enz- IS biti nešto manji. Upravo zbog toga ukupna količina proizvoda i maksimalna brzina enzimske reakcije je nešto manja.
Ireverzibilna nekonkurentska inhibicija
Postoji široka lista otrova enzima koji nepovratno inhibiraju datu enzimsku aktivnost. Od značajnijih treba pomenuti cijanide (CM— ), koji vezujući se za teški metal Fe inaktiviraju enzim citohrom c oksidazu, blokiraju respiratorni lanac u mitohondrijama i dovode do smrti. Ireverzibilna inhibicija enzima sa — SH aklivnom grupom nastaje dejstvom jodacetamida. Diizopropil- fluoro-fosfat blokira enzime sa serinskom OH grupom u aktivnom centru. Zatim, postoje inhibitori tipa teških metala (Hg+, Ag+ i drugi), koji blokiraju enzimsku aktivnost. Najzad, postoje i anti-enzimi (antitijela) koji se pojavljuju u cirkulaciji životinja poslije parenteralnog unošenja enzima.
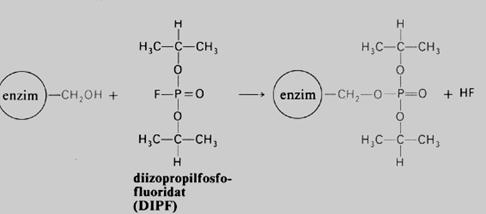
Slika 11. Ireverzibilna nekonkurentska inhibiclja enzima
KATALITIČKI CENTAR ENZIMA
Katalitički centar i1i aktivno mjesto enzima je ona regija u molekulu enzima-proteina pomoću koje ovaj ispoljava svoje dejstvo — katalizu odgovarajuće reakcije (dehidrogenaciju organskog supstrata, dekarboksilaciju, dezaminaciju ili raskidanje neke druge veze).
Sudeći prema relativno velikoj molekulskoj težini enzima u odnosu na supstrat, ranije se vjerovalo da je katalitički centar jedna vrlo ograničena regija u peptidnom lancu enzima. Ovo klasično shvatanje danas je umnogome korigovano zahvaljujući napretku u proučavanju ne samo aminokiselinskog sastava i njihovog redosleda u peptidnom lancu, već i viših vidova njegove strukture (prostorni raspored reaktivnih grupa enzima i njihovog međusobnog odnosa).
Radi boljeg razumjevanja promjena koje nastaju u molekulu enzima tokom njegove aktivnosti, najpre će biti prikazano klasično shvatanje modela katalitičkog centra. Prema modelu Emila Fischera, supstrat i enzim pokazuju strogu podudarnost kao ključ prema bravi.
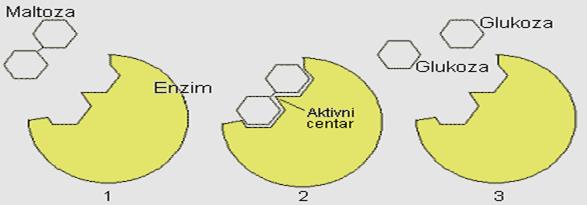
Slika 12. Mehanizam „ključ-brava"
ZNAČAJ METALNIH KATJONA ZA DEJSTVO ENZIMA
Postoji veliki broj enzima čije dejstvo zavisi od prisutnog metalnog jona. Najčešće to su joni Ca1+, Cu2+, Fe2+, Mn2+ itd. Smatra se da jedna četvrtina svih dosad poznatih enzima koristi katjone metala bilo kao nezamjenljive faktore katalize, bilo kao činioce koji dejstvuju u smislu stabilizacije strukture enzima — proteina. Lista ovih enzima je vrlo duga za sistemntsko nabrajanje, zbog toga će biti navedene samo neke od značajnijih grupa, čije dejstvo se ne odvija bez prisutnog katjona odgovarajućeg metala. To su enzimi tipa kinaza, liaza, dekarboksilaza, dezaminaza, pepsidaza i citohrom c oksidaza.
U pogledu čvrstine jona metala i enzima postoje dvije podgrupe ovih enzima — metalaktivirajući enzimi i metaloenzimi. Prvi, metalaktivirajući enzimi, lako gube svoj metal tokom dijalize i postupaka prečiščavanja, što nije slučaj sa metaloenzimima. Uklanjanje metala prekida enzimsku aktivnost, ponovno dodavanje metala je obnavlja. Očigledno radi se o reverzibilnoj pojavi.
Tokom reakcije sa supstratom jon metala može nagraditi 4 različita kompleksa:
- Enz-M-S (enzim-metal-supstrat)
- M-Enz-S (metal-enzim-supstrat)
- Enz-S-M (enzim-supstrat-metal)
- ciklični Enz-M kompleks
Svakako, grupa pravih metaloenzima može nagraditi komplekse pod 1) i 2) i eventualno, ciklični kompleks. Kombinacija pod 3), gde se jon metala vezuje preko supstrata, pripada grupi metalaktivirajućih enzima.
Zbog različitog mjesta vezivanja uloga jona metala je različita, što je opet u zavisnosti od vrste nastalog kompleksa. U prvom slučaju (Enz-M-S) jon metala može imati kuplujući (vezujuću) ulogu, gdje aktivira katalitički centar, ili vezuje supstrat, kao što to čini receptorska grupa.
U drugom slučaju (M-Enz-S) jon metala, po svojoj prilici, ima ulogu stabilizatora strukture, vjerovatno, održavanjem najpovoljnije komformacije molekula enzima, a naročito njegovog katalitičkog centra.
U trećem tipu kompleksa (Enz-S-M) jon metala, po svojoj prilici, djeluje prema supstrat na taj način što na njemu izaziva strukturne promjene takvog tipa da pojedine regije veze budu izložene i pogodne za dejstvo enzima.
U nekim slučajevima transfera (prenosa) fosfata (gdje je ATP supstrat), nastaje najprije gubitak odgovarajućeg broja molekula vode pod dejstvom jona metala.
Tek ovako pripremljeni supstrat u kompleksu sa metalom ima aktivirane atome i najpogodniju komformaciju za dejstvo enzima.
ZAKLJUČAK
Enzimi su životno važne tvari za biljke, životinje i ljude. Svi životni
procesi su uredan i integriran slijed enzimskih reakcija. Enzimi se nazivaju
i biokatalizatori, što znači da oni aktiviraju i ubrzavaju životne procese
kao što su disanje, dioba ćelija i varenje, jer su mnoge reakcije koje
se odvijaju u ćelijama organizma prespore te bi vodile do bitno drugačijih
produkata koje organizmu ili ne trebaju, ili bi štetili.
Normalno funkcionisanje metabolizma (skup svih hemijskih reakcija u organizmu)
je moguće samo zbog djelovanja enzima.Razlaganje velikih makromolekula
unesenih ishranom (bjelančevina,masti itd.) na njihove prostije komponente
zbog lakšeg varenja regulisano je digestivnim enzimima (tripsin,amilaza,pepsin
itd.).
Replikacija DNK je u velikoj mjeri zavisna od enzima (lipaza,DNK polimeraza itd.) kao što je i zgrušavanje krvi regulisano dejstvom enzima trombina.
Danas je poznato preko 5000 enzima koji imaju važnu ulogu u životnim procesima,
pogreška (genetske mutacije, nedovoljna proizvodnja, ili hiperprodukcija enzima) jednog jedinog enzima može biti glavni uzrok enzimopatija ili enzimskih bolesti.
Najčešće enzimopatije :
- Albinizam – nedostatak pigmenta u kosi, koži i očima;
- Taj-Saksova bolest – poremećaj metabolizma, koji dovodi do umne zaostlosti;
- Alkaptonurija – poremećaj metabolizma, koji dovodi do artritisa;
- Dr Julijana Petrović, dr Smiljana Velimirović: HEMIJA za IV razred gimnazije, Zvod za udžbenike i nastavna sredstva , Beograd, 2000.
- Grupa autora: OPŠTA ENCIKLOPEDIJA, Prosveta, 1978.
- Priručnici za lekare, Dr Siniša B. Bogdanović, Enzimi, ¨Medicinska knjiga¨, Beograd, 1949.
- Medicinski leksikon 1 ¨Vuk Karadžić¨- Larousse, (urednik: Radomir Ječinac, Beograd, 1983.
- Medicinski leksikon 2 ¨Vuk Karadžić¨- Larousse, (urednik: Radomir Ječinac, Beograd, 1983.
- Dr E. Noler: ORGANSKA HEMIJA
preuzmi
seminarski rad u wordu » » »


