OSTALI SEMINARSKI RADOVI
IZ MEDICINE |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
IZVORI I ULOGA KALCIJUMOVIH JONA U FUNKCIONISANJU ĆELIJA MIOKARDA
Kalcijum (Ca, lat. Calcium) je metal IIA grupe koji je široko rasprostranjen u prirodi. Poseduje 6 stabilnih izotopa. Koncetracija kalcijuma u punoj krvi kod domaćih životinja se kreće od 2-3,5 mmol/l. Normokalcemija (normalna koncetracija Ca2+ u krvi i vanćelijskoj tečnosti) se održava u fiziološkim granicama zahvaljujući radu paraštitaste žlezde, posredstvom parathormona (PTH) koga ona luči. Naime, PTH stimuliše sintezu aktivnog oblika vitamina D u bubrezima, koji je neophodan da bi došlo do sinteze nosača potrebnih za resorpciju kalcijuma iz tankih creva.
Kalcijum se u organizam unosi putem hrane, najčešće u obliku nerastvorljivih neorganskih soli. One se u želudcu, pod dejstvom hlorovodonične kiseline, prevode u rastvorljive soli, kao što su kalcijum-hlorid i kalcijum-fosfat, pa se kao takve aktivnim transportom u crevima resorbuju u krvotok i koriste u organizmu za mnogobrojne funkcije.
Najveći deo, približno 99% kalcijuma u organizmu, se nalazi u kostima i zubima, dajući im mehaničku čvrstinu. Preostali deo kalcijuma je u ekstracelularnoj tečnosti i mekim tkivima. On ima višestruku ulogu: deluje kao aktivator enzima, ima vrlo značajnu ulogu u mehanizmu zgrušavanja krvi, aktivaciji mehanizma kontrakcije poprečno-prugastih, glatkih mišića i miokarda. Bitan je za normalno funkcionisanje nervnog sistema kao i za regulaciju nervno-mišićne razdražljivosti, jer se joni kalcijuma nalaze na ulazu u natrijumove kanale u membrani nervnih i mišićnih ćelija.
Kalcijum je neophodan i za normalno funkcionisanje srčanog mišića. Osnovni izvori kalcijuma potrebni za obavljanje funkcija srca jesu kalcijum koji potiče iz krvi i kalcijum koji je skladišten u sarkoplazmatskom retikulumu (SR) kardiomiocita tzv. intracelularni kalcijum. Zahvaljujući neprestanoj difuziji kalcijumovih jona, omogućeno je naizmenično smenjivanje kontrakcije (sistole) i relaksacije (dijastole) srčanog mišića. U slučajevima kada se kalcijum nađe u višku ili kada ga je manje nego što je potrebno, tj. kada iz bilo kog razloga dođe do poremećaja homeostaze intracelularnog kalcijuma, javljaju se problemi vezani za rad srca, koji za posledicu imaju nastanak brojnih kardiomiopatija (aritmije, hipertrofije i sl.).Homeostaza kalcijumovih jona i sarkoplazmatski retikulum
Svaki mišić, bilo da je poprećno-prugasti ili glatki, je izgrađen od velikog broja tankih i dugačkih ćelija tzv. mišićnih vlakana. Ova mišićna vlakna, kao i sve druge ćelije, poseduju membranu-sarkolemu i citoplazmu-sarkoplazmu u kojoj su potopljene ćelijske organele. Najveći deo zapremine sarkoplazme je ispunjen kontraktilnim organelama-miofibrilima. Miofibrili su osnovne funkcionalne jedinice mišićne ćelije i oni su građeni od tankih-aktinskih i debelih-miozinskih miofilamenata. Ostatak sarkoplazme je ispunjen velikim brojem mitohondrija, zatim tu su: sistem kanala i tubula, tj. sarkoplazmatski retikulum, Goldži aparat, zrnca glikogena, masne kapljice, mioglobin, kao i velika količina različitih jona, poput K+, Na+ ,Cl- i posebno Ca2+.
Kalcijum zauzima centralno mesto u kontroli srčanog rada i njegove kontraktilnosti. U srčanom mišiću, glavni izvori Ca2+ koji je potreban za kontrakciju i relaksaciju sarkomera, jesu depoi kalcijuma u sarkoplazmatskom retikulumu i Ca2+ krvi. Za vreme svakog otkucaja srca, ekstracelularni kalcijum ulazi u citoplazmu kardiomiocita kroz L-kalcijumova kanale ( L-type Ca2+ channels, LTCC;eng.), koji se nalaze na posebnim invaginacijama plazma membrane, tzv. transverzalnim tubulima (T-tubuli) – (Sl. 1). Povećanje koncentracije intracelularnog kalcijuma uslovljava dalje oslobađanje kalcijuma iz sarkoplazmatskog retikuluma posredstvom tzv. rianodinskih receptora - RyR (Sl. 2).
Slika 1. T-tubul Slika 2. Rianodinski receptor
Rianodinski receptori (RyR) su vrsta intracelularnih, tetramernih kalcijumovih kanala koji se nalaze na membrani sarkoplazmatskog retikuluma u različitim vrstama nadražljivih tkiva životinja, poput onih u skeletnim mišićima (RyR1), srčanom mišiću (RyR2) i mozgu (RyR3). Interakcija RyR-a sa proteinom FKBP12.6 stabilizuje ovaj kanal, držeći ga zatvorenim i redukujući njegovu aktivnost. Međutim, fosforilacija RyR-a od strane Protein Kinaze A (PKA) rezultuje disocijacijom proteina FKBP12.6 i čini da ovaj kanal na svojoj citosolnoj strani postane vrlo osetljiv na prisustvo kalcijuma. Zbog toga, dolazi do naglog otvaranja ovih jonskih kanala i oslobađanja velikih količina kalcijumovih jona deponovanih u sarkoplazmatskom retikulumu (Sl. 2), čime se povećava koncetracija slobodnog intracelularnog kalcijuma otprilike desetostruko. Ovaj proces je označen kao kalcijum-indukovano-oslobađanje-kalcijuma (Calcium Induced Calcium Realising, CICR, eng.). Oslobođeni kalcijumovi joni se vezuju za proteinsku subjedinicu aktina, Troponin-C. Vezivanje jona kalcijuma je okidač mišićne kontrakcije, jer dolazi do povezivanja aktinskih i miozinskih miofilamenata (stvara se aktin-miozinski kompleks), tj. aktinski filamenti klize preko miozinskih i tako dolazi do skraćivanja sarkomera, odnosno nastaje kontrakcija mišića. Ovaj proces je nazvan eksitacitaciono-kontrakcijska spojnica, jer olakšava prevođenje električnog stimulusa u mehanički rad. Da bi došlo do opuštanja odnosno relaksacije mišića, potrebno je da se Ca2+ vrati u SR i ECT. Prema dosadašnjim saznanjima, oko 70% citoplazmatskog kalcijuma se vraća u sarkoplazmatski retikulum, oko 28% se izbacuje van ćelije posredstvom Na+ /Ca2+ izmenjivača a samo 2% Ca2+ izlazi iz ćelije aktivnim transportom kroz ćelijsku membranu.Sarco (endo) plazmatski retikulum Ca2+ -ATPaza (SERCA)
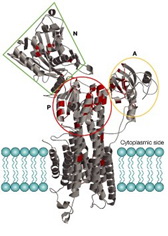
Kao što je već navedeno, da bi došlo do relaksacije srčanog mišića, odnosno dijastole, neophodno je da se smanji koncetracija slobodnog intracelularnog kalcijuma u citoplazmi, što se većinskim delom postiže uz pomoć pumpi koje se nalaze na membrani sarkoplazmatskog retikuluma, a označavaju se kao sarco(endo)plazmatski retikulum Ca2+ - ATPaza (SERCA). Postoje dve izoforme SERCA-e: SERCA1a i SERCA2a. SERCA1a se nalazi u skeletnim mišićima i SERCA2a, koja se nalazi u srčanom mišiću. SERCA2a je transmembranski protein molekulske mase 110kDa koji se nalazi u membrani SR-a i transportuje dva Ca2+ iz citosola ćelije u lumen SR-a, suprotno gradijentu koncetracije, na račun energije dobijene hidrolizom ATP-a. Energija za ovaj transport je neophodna jer SR ima čak 10000 puta veću koncetraciju kalcijumovih jona u poređenju sa onom u citoplazmi miocita, zahvaljujući proteinu kalsekvestrinu koji vezuje 43 jona kalcijuma u SR-u i tako pomaže u redukovanju koncetracije Ca2+ u njemu. Svojom aktivnošću SERCA2a kontroliše istovremeno brzinu uklanjanja Ca2+ iz citosola kao i stepen punjenja sarkoplazmatskog retikuluma kalcijumovim jonima, što pokazuje da SERCA2a ima centralnu ulogu u relaksaciji i kontrakciji srčanog mišića. Struktura SERCA2a je opisana tokom eksperimenta u kojem su kristali Ca2+ -ATPase bili prelomljeni uz pomoć X-zraka (Sl. 3). Uočeno je da ona ima jedan membranski i tri citoplazmatska domena: nukleotidni (N), fosforilacijski (P) i pokretački (A). Membranski domen sadrži deset (M1-M10) helikoidnih segmenata koji su ugrađeni u membranu i u okviru njih se nalaze oba Ca2+ vezujuća mesta. Takođe eksperimentalno je dokazano da cepanjem veze između A-domena i membranskog domena možemo onemogućiti transport kalcijumovih jona već pri samom njegovom početku, a da se pri tome ne naruši osnovna struktura i izgled SERCA2a. To znači da A-domen (pokretački) ima centralno mesto u transportu kalcijumovih jona nazad u sarkoplazmatski retikulum.
Slika 3. Prikaz SERCA2a
Kako bi se dokazalo da SERCA2a pumpa ima veliku ulogu u održavanju homeostaze Ca 2+ i regulisanju funkcija srca, korišćene su transgene labaratorijske životinje (miševi). Kada je kod njih aktivnost SERCA2-e bila povećana 1,5 puta to je rezultovalo povećanim transportom Ca2+ u/iz sarkoplazmatskog retikuluma, tj. povećala se učestalost kontrakcija i relaksacija srca. Kod životinja nije bilo oboljenja srca, što znači da pojačana aktivnost SERCA-e može biti tolerisana. Nasuprot tome, odsustvo SERCA2 gena je letalno. Miševi koji su homozigoti (SERCA2a-/-) su uginjavali u ranom stadijumu razvoja. Heterozigotni (SERCA2a+/-) miševi su sposobni za život, ali imaju za 35% smanjenu količinu SERCA2 jer im nedostaje jedna kopija SERCA2 alela. Iako ni kod ovih životinja nisu pronađene patološke promene na srcu, smatra se da smanjenje koncetracije SERCA2 u kombinaciji sa visokim krvnim pritiskom, svakako pretstavlja ubrzan put ka nastanku slabosti srca. Ustanovljeno je da ovi miševi imaju povećanu koncetraciju intracelularnog Ca2+ i smanjenu kontraktilnost srčanog mišića, što nam govori da je neophodno prisustvo dve funkcionalne kopije SERCA2a gena kako bi se obezbedio efikasan promet Ca2+ u SR i samim tim, pravilan rad srca. Sposobnost SERCA2a da pumpa kalcijum nazad u sarkoplazmatski retikulum je regulisana uz pomoć Fosfolambana (PLN/PLB) i Sarkolipina (SLN), dva mala modulatorna proteina u membrani sarkoplazmatskog retikuluma.Fosfolamban (PLN)
Fosfolamban (Phospholamban, PLN-eng.) je transmembranski protein sarkoplazmatskog retikuluma koga sačinjavaju 52 aminokiseline (Sl. 4). Prvi put ga je opisao Arnold Katz i sar. 1974. godine. Ovaj protein je zastupljen pretežno u srcu, mada ga ima i u skeletnim i glatkim mišićima, ali u znatno manjoj količini.
A) B)
Slika 4. Fosfolamban (PLN): A) pentamer B) monomer
Na fosfolambanu se zapažaju tri različita domena. To su: veliki, helikoidni, citoplazmatski domen koji se označava kao IA i obuhvata aminokiseline 1-20, zatim nestrukturirani domen, tzv. petlja ili domen IB, sa aminokiselinama 21-30, i na kraju domen II sa aminokiselinama 31-52 koji formira hidrofobni transmembranski heliks. U interakciji sa SERCA učestvuju kako citoplazmatski domeni (IA i IB) tako i transmembranski domen PLN-a. Velika fleksibilnost, omogućena posredstvom specifične građe domena IB, omogućava da fosfolamban bude prepoznat od strane odgovarajućih enzima.
U membrani sarkoplazmatskog retikuluma postoje pentamerne i monomerne forme fosfolambana (Sl. 4.). Monomerne forme su zapravo osnovne funkcionalne jedinice, a pentamerne forme se ponašaju kao rezervoari. Zahvaljujući NMR (nuclear magnetic resonance) ispitivanjima utvrđeno je da postoje dva različita pentamerna modela fosfolambana. Bellflower model opisuje pentamer čiji transmembranski delovi protomera su malo povijeni i obrazuju poru u membrani, a citoplazmatski heliksi su orijentisani skoro normalno u odnosu na nju, tj. neznatno ukošeni ka centru same pore (slika 5). Pinwheel model ima transmembranske domene koji su gotovo pravi, a citoplazmatski domeni su smešteni u ravni sa membranom SR-a (slika 6).
Slika 5. Bellflower model Slika 6. Pinwhell model
Pri niskim koncetracijama kalcijumovih jona u citoplazmi, fosfolamban reaguje sa SERCA2a tako što reverzibilno inhibiše njenu aktivnost, odnosno smanjuje afinitet SERCA2a za Ca2+ i sprečava da se Ca2+ joni kroz nju vrate nazad u sarkoplazmatski retikulum. Međutim, pri visokim koncetracijama Ca2+ dolazi do razdvajanja komplexa SERCA2a/PLN i nastaju Ca2+ -izazvane konformacione promene na SERCA2a. Da bi prestalo inhibitorno dejstvo PLN-a, on se mora fosforilisati. Postoje tri aktivna mesta na IA domenu na kojima se vrši fosforilacija. To su Ser-10 koji se fosforiliše Protein kinazom C (PKC), Ser-16 koji se fosforiliše Protein kinazom A (PKA) ili PKC i Thr-17 koji se fosforiliše uz pomoć enzima Kalmodulin kinaze II (CaM kinase II). Fosforilacijom Ser-16 (ili Thr-17) se direktno proporcionalno postiže povećanje aktivnosti SERCA2a, koja sada aktivno vraća Ca2+ nazad u SR i tako otpočinje relaksacija mišića. Istovremena dvostruka fosforilacija Ser-16 i Thr-17 ne uzrokuje povećanu stimulaciju SERCA2a u odnosu na onu koja je postignuta monofosforilacijom.
Stimulus koji mora da postoji i koji je neophodan da bi došlo do fosforilacije, jeste β-adrenergička stimulacija srčanog mišića. Sada se zna da postoji još jedan stimulus za fosforilaciju Ser-16, a to je trošenje Ca2+ rezervi iz SR-a, nastalo zbog izlaganja miocita inhibitorima SERCA2a. Fosforilacija se tada dešava kako bi se povećao unos Ca2+ u sarkoplazmatski retikulum u pokušaju da se on dovoljno dopuni.Sarkolipin (SLN)
Sarkolipin (Sarcolipin, SLN-eng.) je integralni protein koga čine 31 aminokiselina. On inhibitorno deluje na SERCA1a i SERCA2a, smanjujući njihov očigledni afinitet za Ca2+, pa tako sprečava relaksaciju mišića. Inhibitorno dejstvo SLN-a na SERCA2a pumpu je omogućeno β-adrenergičkom stimulacijom, što znači da je SLN reverzibilni inhibitor. Kod malih sisara, sarkolipin je predominantan u miokardu pretkomora srca, dok se u miokardu komora i u skeletnim mišićima nalazi u vrlo malim količinama. Nasuprot tome, kod velikih sisara ga ima u obilju u skeletnim mišićima, a u samom srcu jako malo. Količina sarkolipina u pretkomorama malih sisara se može znatno menjati, u zavisnosti od pato-fiziološkog stanja u kome je srčani mišić. Tako, kod pasa koji imaju neku srčanu slabost, količina ovog proteina se može utrostručiti, dok kod miokarda koji je sklon ishemiji ga ima i do 30% manje nego što je normalno. Sarkolipin i fosfolamban u pretkomorama se uvek nalaze u stanju dinamičke ravnoteže, jer je uvek gubitak fosfolambana nadomešten pojačanom regulacijom od strane sarkolipina i obrnuto, u slučaju suficita sarkolipina, smanjuju se količine fosfolambana.
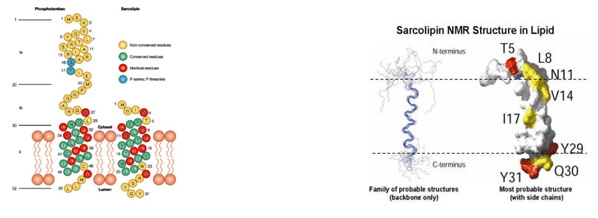
Sarkolipin je heliks, po svojoj građi vrlo sličan transmembranskom domenu fosfolambana i zapravo oni imaju 30% identičnosti u genetskom pogledu, iz čega proizilazi da su ova dva polipeptida vezana za SERCA-u na sličan način (Sl. 7). Zahvaljujući ispitivanjima pomoću NMR je ustanovljeno da se sarkolipin sastoji iz četiri dinamička subdomena: u citoplazmi je kratki nestrukturirani hidrofilni N-terminus (rezidue 1-6), zatim kratki dinamički heliks (rezidue 7-14) i čvrsti deo heliksa (rezidue 15-26) koji zajedno čine hidrofobni transmembranski deo i nestrukturirani hidrofilni C-terminus (rezidue 27-31) koji je u lumenu sarkoplazmatskog retikuluma (Sl. 8).
Slika 7. Sličnost PLN i SLN Slika 8. Sarkolipin u lipidnom dvosloju
U okviru N-terminusa se nalazi aktivno mesto Thr-5 (T5) za fosforilaciju sarkolipina uz pomoć enzima Kalcijum-kalmodulin zavisne protein kinaze (CaMKII). Fosforilacijom se gubi inhibitorno dejstvo na SERCA2a jer se prolaz Ca2+ u unutrašnjost sarkoplazmatskog retikuluma drastično povećava, što rezultuje nastankom miorelaksacije. Nakon defosforilacije, SERCA je ponovo inhibirana što joj omogućava transmembranski deo heliksa SLN-a jer on fizički interaguje sa SERCA2a. Smatra se da je osnovna uloga C-terminusa da obezbedi zadržavanje SLN-a u zidu SR-a, mada je u skorije vreme dokazano da C-terminus svojom fleksibilnošću omogućava reziduama Tyr-29 i Tyr-31 da interaguju sa različitim aromatičnim reziduama iz transmembranskog heliksa SERCA-e, što znači da on istovremeno učestvuje i u regulaciji SERCA-SLN sistema.
Eksperimentalno je dokazano da prekomerna ekspresija sarkolipina u atrijalnom delu miokarda smanjuje kalcijum-zavisni unos kalcijuma, što dovodi do smanjene kontraktilnosti srca. S druge strane, delimičan ili potpuni nedostatak sarkolipina povećava unos kalcijuma u ćelije miocita pretkomora i komora srca, što posledično povećava učestalost kontrakcija i relaksacija srčanog mišića.
Zaključak
Mišićne ćelije srca odgovaraju na stimulus oslobađanjem Ca2+ jona iz depoa u sarkoplazmatskom retikulumu. Kalcijum izlaže miozinu vezujuća mesta na aktinskom filamentu, što omogućava klizanje aktina po miozinu, što za posledicu ima nastanak kontrakcije mišića. Da bi se mišićna vlakna opustila, Ca2+ mora biti vraćen iz citoplazme u SR. Zato se u membrani sarkoplazmatskog retikuluma nalazi sarco(endo)plazmatski retikulum Ca2+ -ATPase (SERCA) koja transportuje dva Ca2+ jona suprotno gradijentu koncetracije, pritom koristeći energiju koja je dobijena hidrolizom ATP-a. Ulazak Ca2+ u SR preko SERCA-e je regulisan uz pomoć dva transmembranska proteina – fosfolambana i sarkolipina, koji deluju kao inhibitori. Inhibicija slabi i nestaje fosforilacijom ovih proteina odgovarajućim enzimima i to su: fosforilacija fosfolambana na rezidui Ser-16 enzimom Protein kinaza A (PKA) ili rezidui Thr-17 uz pomoć enzima Ca2+ -Calmodulin zavisna protein kinaza (CaMKII). Ovaj enzim može da fosforiliše i sarcolipin na rezidui Thr-5. Kao rezultat fosforilacije regulatornih proteina SERCA-e, dolazi do naglog povratka Ca2+ jona u depoe SR-a, čime se smanjuje koncetracija slobodnog kalcijuma u citoplazmi miocita i dolazi do njihove relaksacije.
Kontraktilnost i pravilnu funkciju srčanog mišića regulišu PLN/SLN-SERCA kompleks. Ukoliko dođe do poremećaja funkcije bilo kog od ovih proteinskih sistema, nastaju makroskopske promene u srčanom mišiću, koje su često ireverzibilne. Zato se u današnje vreme ovi proteini sve više proučavaju i nastaje nova generacija lekova koji će delovati regulatorno na funkciju fosfolambana i/ili sarkolipina i na taj način preveniraju srčana oboljenja, ili pak otklanjaju njihove posledice.
Spisak literature:
1. Vafiadaki E and co, 2008, The role of SERCA2a/PLN complex, Ca2+ homeostasis, and anti-apoptotic proteins in determining cell fate, Cardiovascular physiology, 457, 687-700.
2. Maffeo C, Aksimentiev A, 2009, Structure, Dynamics and Ion Conducance of the Phosholamban Pentamer, Biophysical Journal, 96,4853-4865
3. Traaseth NJ and co, 2008, Structural and dinamic basis of phospholamban and sarcolipin inhibition of Ca2+ -ATPase,Biochemistry,47(1),3-13.
4. Bhupathy P, Babu GJ, Periasamy M, 2007, Sarcolipin and phospholamban as regulators of cardiac sarcoplasmic reticulum Ca2+ ATPase, J Mol Cell Cardiol, 42(5), 903-911.
5. Periasamy M, Kalyanasundaram A, 2007, SERCA pump isoforms: Their role in calcium transport and disease. Muscle & Nerve, 35: 430–442.
6. Bhupathy P and co, 2009, Threonine-5 at the N-terminus can modulate sarcolipin function in cardiac myocytes, J Mol Cell Cardiol., 47(5), 723-729.
7. Stojić V, 2004, Veterinarska fiziologija, Naučna KMD, Beograd.
preuzmi
seminarski rad u wordu » » »